-Signicifaco biológico de las proteínas: proteína viene del griego Proteos, que significa cualquier forma y de otra palabra griega, proteios, que significa primero.
Otras características de las proteínas es que tienen actividad vital.
Son polímeros, de monómeros distintos. Esto tiene una consecuencia y es que tiene un orden de aminoácidos(Aa) y ese orden es la información sobre su forma. La forma de las proteínas determina la función de estas.
Son polímeros lineales de aminoácidos en un número muy elevado, llamadas macromoléculas. Son muy complejas y grandes. Se montan y se desmontan fácil y constantemente, los cual nos explica la regerenación de los seres vivos.
Los enlaces de las proteínas se rompen por hidrólisis:
El PH baja y sube +H +H
Proteína-->Polipétidos (más de 10 Aa)-->Péptidos (2-10 Aa)--> 20 Aa
Alta Tº,sal detergente.
- AMINOÁCIDOS
Tienen un grupo amino y un grupo ácido.
- Propiedades de los aminoácidos
1.1) Carácter ácido/básico
Se comportan como ácidos a PH básicos y viceversa.
Curva de titulación de la alanina, hay que conocer sus valores de PK:
PK1: 2.3
PK2: 9.69
1.2.) Polares
Son solubles en agua, cristalizan y tienen un punto de fusión alto, como el H2O.
1.3.) Isomería espacial
Al igual que los monosacáridos, la isomería espacial era debido a los carbonos asimétricos.
La glicocola por ejemplo, no tiene isomería espacial.
2. Clasificación de los Aminoácidos.
3) Enlace peptídico.
Es el enlace mediante en cual se unen los aminoácidos.
Interviene
el grupo ácido de un Aa y el grupo amino del siguiente Aa. El NH2 del
1º Aa lo tiene libre y el último Aa tiene el grupo ácido libre.
El enlace de los aminoácidos se rompe por hidrólisis.
La característica de este enlace es que es resonante, tiene una parte sencilla y una parte doble.
Los
átomos peptídicos, obligan a los átomos de carbono a que estén siempre
en el mismo plano para poderlos compartir. No pueden girar unos
respectos a otros.
Forma en la que el carbono alfa determina la forma de la proteína:
 |
| Carbono alfa |
ESTRUCTURA DE LAS PROTEÍNAS:
Cada proteína esta formada por aminoácidos colocados siempre en el mismo orden.
Esta secuencia de aminoácidos es lo que contribuye la estructura primaria de la proteína. Aa1 Aa2...Aa17...
La estructura primaria determina las demás estructuras de las proteínas, es decir, su forma y su funcionamiento.
 |
| Estructura primaria |
También
determina las propiedades de las proteínas, una de ellas es la
especificidad: la misma proteína en distintos seres vivos tiene distinta
estructura primaria.
Se
comprobó pues, que todas las estructuras no eran alargadas, con una
difracción de rayos X, que no eran extendidas, sino que presentaban
muchas más estructuras, formando un enlace nativo que es el estado de
más baja energía, el más estable por poseer más enlaces.
En estado nativo se encontró una estructura secundaria, que es el resultado del giro del carbono alfa en la estructura primaria.
1. Tipos de estructuras secundarias:
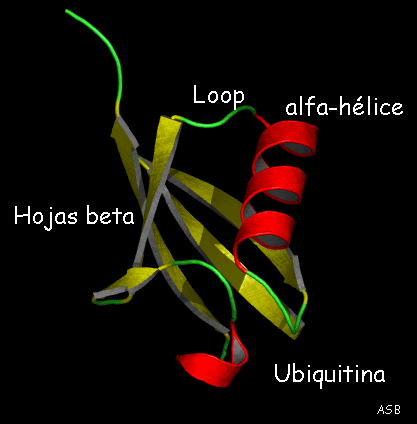
- Alfa-hélice: el carbono alfa gira helicoidalmente en torno a un eje imaginario con 3.6 Aa/vuelta. Siempre tiene que haber la misma cantidad de Aa porque de esta manera cada 4 Aa quedan enfrentados en la posición geométrica adecuada, la distancia y la orientación de los átomos. Los puentes de que estabilizan la hélice son intracatenarios, es decir, están dentro de la cadena de Aa.
- Beta-hoja plegada: en la línea quebrada de la estructura primaria, los carbonos alfa actúan como puentes de plegamiento. Se mantiene por los átomos peptídicos de dos cadenas paralelas, o una replegada. Quedan en la posición geométrica adecuada para formar puentes de hidrógeno, estos puentes de hidrógeno son intercatenarios, entre dos cadenas paralelas.
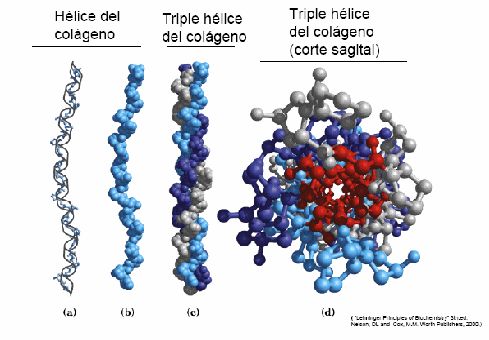
- Triple hélice de colágeno: el colágeno es una proteína muy frecuente en los huesos. En su estructura primaria el colágeno es una proteína que contiene gran cantidad de Aa de prolina e hidroxiprolina. La prolina tiene un grupo amino ciclado, cuando forma un enlace peptídico el único hidrógeno se pierde. Las tres hélices se mantienen unidas mediante puentes de hidrógeno intercatenarios.
2. Estructura terciaria.
Realmente
ninguna proteína está completamente estructurada ni es pura. Lo normal
es que tengan unas partes estructuradas y otras en las que no hay ningún
tipo de estructuras secundaria, lo que se llama discontinuidades.
El
conjunto de las estructuras secundarias que presenta una proteína y sus
discontinuidades constituye la estructura terciaria de la proteína que
es el estado nativo.
La estructura terciaria también va a ser determinada por la estructura primaria.
- Causas de las discontinuidades: en la estructura secundaria que determinan también la estructura terciaria.
- Prolina e hidroxiprolina: rompen la estructura secundaria por su incapacidad para formar puentes de hidrógeno.
- Aa con restos apolares: como son hidrófobos y están rodeados de agua se introducen en la cadena huyendo del H2O.
- Aa con restos polares con carga: Si son cargas iguales se repelen y si son distintas se atraen. Tanto si se repelen como si se atraen, rompen la estructura secundaria y produce discontinuidad. Esto sucede cuando están próximos.
- Cisteinas enfrentadas posición geométrica adecuada: Se enlazan por puentes de disulfuro, al enlazarse producen discontinuidad.
La estructura terciaria se mantiene gracias a nuevos enlaces que se forman entre Aa ahora próximos por la estructura terciaria.
Los enlaces que mantienen la estructura terciaria:
Dependen de los Aa y posiciones, esto es la estructura primaria.
Los enlaces son débiles y numerosos:
- Puentes de hidrógeno: se establece entre el hidrógeno y un átomo electronegativo cargados.
- Interacciones iónicas: esto ocurre por ejemplo, entre Aa cargados con distinto signo y próximos.
- Fuerzas de Van Der Waals: se establece entre Aa con hidrocarburos y con Aa con anillos próximos. Hay muchos electrones compartidos y electrones libres y saltan de un enlace a otro provocando cargas eléctricas de distinto signo.
 |
| Van Der Waals |
- Interacciones hidrofóbicas: esto ocurre con los Aa con restos apolares. Estos restos se introducen en las cadenas huyendo del agua y además se reunen entre ellos porque son lipofilos, formando un enlace que mantiene la estructura terciaria.
Todos estos enlaces son débiles, pero suficientemente numerosos para hacer que la estructura terciaria permanezca.
Además
de todos estos enlaces débiles, hay un enlace fuerte, un enlace
covalente, este es el que se establece entre cisteinas que se encuentran
enfrentadas y próximas, enlaces por puentes de disulfuro.
Igual
que hay proteínas sin subunidades, también las hay con subunidades, es
lo que constituye la estructura cuaternaria de la proteína.
3. Estructura cuaternaria.
Todos los enlaces de esta estructura son débiles y numerosos. No tienen puentes de disulfuro.
La
forma de una proteína en su estructura terciaria o cuaternaria, depende
de enlaces débiles que se alteran cambiando la forma, lo que
desembocará con su funcionamiento.








No hay comentarios:
Publicar un comentario