ENZIMAS
http://www.ehu.es/biomoleculas/enzimas/tema11.htm
- Características de la catálisis enzimática:
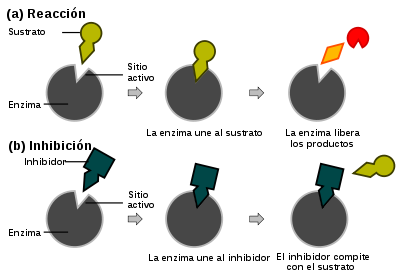
- Complejo enzima sustrato y centro activo
2. Especificidad
Las
enzimas son estereoespecíficas con los sustratos, esto es lo que se
llama especificidad de sustrato (formas complementarias).
Especificidad
de grupo: reconoce ciertos grupos químicos en todos los sustratos que
los poseen siempre que tenga la forma complementaria.
Especificidad de acción: cierto aminoácido catalítico solo puede favorecer un tipo de reacción.
3. Cofactores y vitaminas
Hay
muchas enzimas que necesitan necesitan un cofactor para su
funcionamiento. Estos cofactores su unen débil y temporalmente enre sí.
Cuando
se trata de otras moléculas orgánicas, se les llama coenzimas. Las
coenzimas intervienen en la reacción pero tienen que acabar intactos.
Reacciones fosforilación
El ADP y el ATP, actúan como coenzima transportadores de energía.
Se llaman: adenin difosfato (ADP)
adenin trifosfato (ATP)
Se conoce como moneda energética.
Todos los coenzimas son nucleótidos y además son esenciales, no funcionan sin sus enzimas, pero podemos fabricarlos.
Pero
otros coenzimas, como la la coenzima A que transporta otros grupos
químicos como Acetil CA, no lo podemos fabricar pero resultan
imprescindibles y esenciales. Son sustancias que necesitamos en la
dieta, son las vitaminas.
Las vitaminas se definen como sustancias imprescindibles para un organismo pero no pueden fabricarla por si misma.
Algunas
vitaminas la necesitamos como coenzimas y las coenzimas siempre están
asociadas a los enzimas que están en bajas concentraciones. Su falta
produce un déficit de ciertas reacciones metabólicas.
Si
esas reacciones no se producen, se producen vitaminas, llamadas
avitaminosis (escoluto, pelagra, beri-beri), se llaman enfermedades
carenciales.
Las
vitaminas que clasifican en hidrosolubles y liposolubles. Las
hidrosolubles no son tóxicas, se eliminan por la orina. Las
liposolubles, son tóxicas porque no se eliminan con facilidad.
4. Mecanismo para aumentar la eficacia de reacciones enzimáticas: sistemas multienzimáticos y compartimentación.
Un
mecanismo es el que se consigue acoplando las reacciones metabólicas.
Alcanzan mayor cantidad de sustrato con pequeñas cantidades de soluto.
No deben disolverse en todo el hialoplasma.
5. Cinética de las reacciones catalizadas por enzimas: ecuación de Michaelis- Menten
1º Fase: la velocidad es directamente proporcional a la cantidad de sustrato.
2º Fase: la velocidad es proporcional al sustrato pero no directamente.
3º Fase: por mucho sustrato que le eche la velocidad no aumenta más.
Activación e inhibición enzimática
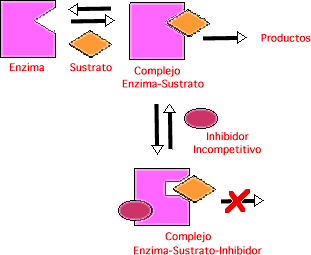
- Inhibición competitiva: el inhibidor compite por el centro activo de la enzima.
- Inhibición acompetitiva: el inhibidor no se une con el inhibidor libre.
- Inhibición no competitiva: el inhibidor une tanto al enzima libre como al enzima sustrato por un lugar distinto del centro acitvo.
-Enzimas reguladores: hay ciertos enzimas con esta característica.
Son enzimas capaces de modificar en muy poco tiempo el estado metabólico de la célula.
Hay dos tipos:
1) Alostéricos: tienen dos centros activos: el centro activo y el centro alostérico. Este último es específico de una sustancia llamada modulador, que puede ser positivo o negativo. El positivo activa la enzima y el negativo inhible a la enzima. Son monovalentes porque tienen un modulador.
Otros son polivalentes, tienen varios centros alostéricos cada uno con un modulador específico.
Por elemplo: L-treonín deshidratasa.Sirve para mantener constante la concentración de isoleucina. Ese mecanismo de regulación que mantiene la constancia en la retroalimentación negativa (la salida influye en la entrada del sistema). Es un mecanismo de control.
También existe un mecanismo de descontrol, la retroalimentación positiva,la entrada y la salida son del mismo signo.
Varios enzimas alostéricos polivalentes quedan unidos por moduladores de varias secuencias multienzimáticas relacionadas producen una red de control.
Son enzimas capaces de modificar en muy poco tiempo el estado metabólico de la célula.
Hay dos tipos:
1) Alostéricos: tienen dos centros activos: el centro activo y el centro alostérico. Este último es específico de una sustancia llamada modulador, que puede ser positivo o negativo. El positivo activa la enzima y el negativo inhible a la enzima. Son monovalentes porque tienen un modulador.
Otros son polivalentes, tienen varios centros alostéricos cada uno con un modulador específico.
Por elemplo: L-treonín deshidratasa.Sirve para mantener constante la concentración de isoleucina. Ese mecanismo de regulación que mantiene la constancia en la retroalimentación negativa (la salida influye en la entrada del sistema). Es un mecanismo de control.
También existe un mecanismo de descontrol, la retroalimentación positiva,la entrada y la salida son del mismo signo.
Varios enzimas alostéricos polivalentes quedan unidos por moduladores de varias secuencias multienzimáticas relacionadas producen una red de control.












No hay comentarios:
Publicar un comentario