Es la principal
molécula de los seres vivos, estamos compuestos de un 70% de agua.
Por ejemplo las
medusas, tienen un 90% de agua.
La cantidad de
agua depende del organismo y de la edad.
Las semillas un
10%
Los huesos un
25%
Estructura
química del agua:
- Siempre la representamos como
una molécula electrónicamente neutra: H2O. La unión del H y O se realiza
mediante enlaces covalentes.
- Los elementos se comparten, ni
se ganan ni se pierden electrones, cargas polares.
- El H y O tienen una electronegatividad,
por los electrones, muy diferentes.
- El O es electronegativo.
- El H es electropositivo.
- Cuando comparten electrones
forman una molécula de agua.
Los electrones
están distribuidos asimétricamente, los electrones están más cerca del O que
del H.
Pero están
eléctricamente cargada, dipolo. El dipolo explica que las propiedades vitales
del agua son las que necesitamos los seres vivos.
Se establecen
enlaces o puentes de hidrógeno, es el que se establece entre un H y un átomo
cargado negativamente.
Las moléculas de
agua están aisladas, se encuentran unidas unas a otras por puentes de
hidrógeno.
En el agua
líquida nos encontramos a las moléculas unidas de 3 en 3, de 4 en 4, de 6 en 6,
etc.; formando tetraedros. Son enlaces que se forman y se rompen continuamente
en millonésimas de segundos.
Los enlaces de
hidrógeno son débiles: son covalentes dativos: los electrones están más cercas
unos de otros. Son anómalas las propiedades del agua.
1) Las
propiedades y funciones del agua.
- Elevado calor específico: se define como la cantidad de calor que hay que darle a 1 gramo de una sustancia para aumentar su temperatura 1º C. El agua es capaz de absorber su calor y aumentar poco su temperatura. La temperatura es una medida de la energía térmica. La energía térmica agita las moléculas. Esto tiene una consecuencia para los seres vivos: amortiguar los cambios de temperatura, esto es vital para los seres vivos. El agua forma nuestro medio interno, que es donde se desarrollan múltiples reacciones químicas, el metabolismo. Por ejemplo: http://www.um.es/molecula/sbqsa04.htm
- Elevado calor de vaporización: Los puentes de hidrógeno son los responsables de esta propiedad. Para evaporar el agua, primero hay que romper los puentes y luego dotar a las moléculas de agua de la suficiente energía para pasar de la fase líquida a la gaseosa. Un claro ejemplo es el siguiente: http://www.um.es/molecula/sbqsa05.htm , muchos de nosotros muchas veces nos haremos la siguiente pregunta: ¿Por qué el hielo flota sobre el agua? http://www.um.es/molecula/sbqsa06.htm
- Elevado punto de fusión y baja densidad en estado sólido:
Elevado punto
de fusión: el paso de sólido a líquido ocurre a temperatura muy alta. El
punto de fusión tan alto permite los tres estados físicos del agua a
temperaturas realmente existentes en la tierra, esto permite el ciclo del agua.
Baja densidad
en estado sólido: El agua en estado líquido tiene menos volumen que en
estado sólido. Cuando el agua se encuentra en estado líquido, los tetraedros y
los puentes de hidrógeno están continuamente rompiéndose y formándose.
Pero cuando el
agua está en estado sólido, los tetraedros y los enlace entre las
moléculas de agua ya presentes en el líquido se hacen permanentes y están
rellenos de aire. El agua sólida tiene más aire que líquida y es menos densa.
El hielo flota sobre el agua, esto permite que no se congele el fondo del mar y
la vida en los mares fríos.
- Alta tensión superficial: Oposición que presenta la superficie de un líquido en la introducción de un sólido. Un cuerpo flota cuando el volumen es mayor que el peso. Pero una aguja puede llegar a flotar (tiene siete veces más peso que volumen).La tensión superficial es una medida de la cohesión que existe entre las moléculas del líquido, es un enlace que hay en el líquido. Las moléculas de agua están unidas entre sí. Esto produce los movimientos celulares. Por ejemplo el zapatero se desplaza por el agua, debido a la tensión superficial.
- Disolvente universal: Esta propiedad se debe al dipolo. El agua tiene cargas eléctricas, entonces cuando se ponen con otra sustancia que también tiene cargas eléctricas, ocurre que se rompen los enlaces iónicos, aísla las cargas eléctricas y rompen los enlaces iónicos y si estos se rompen, se disuelven.
Esto pasa por ejemplo
con el sodio (Na) y el agua (H2O). Solo se disuelven las sustancias polares, se
disuelven el agua.
Esta propiedad
es la que hace que el agua sea el medio interno de los seres vivos, ya que la
mayoría de las materias orgánicas son polares. Esto sirve como medio de
transporte gratuito para las sustancias polares. También determina la forma de
las sustancias apolares (insolubles en agua).
Todas estas
propiedades del agua son pasivas pero también activas, ya que intervienen en
muchas reacciones químicas.
Intervienen en
la hidratación, en la hidrólisis, redox y en la fotosíntesis. Hace falta agua
para sintetizar los ácidos grasos. Gracias a los ácidos grasos, permite
que los camellos acumulen agua y alimentos en su joroba.
2)
Disoluciones y dispersiones acuosas:
El agua es la
mayor parte del medio interno. El medio interno esta formado por hialoplasma,
que es el líquido del interior de la célula, plasma sanguíneo, plasma
intercelular y plasma.
En todos ellos
predomina el agua con otras sustancias. En estas sustancias se dan varios tipos
de propiedades:
- Que sea polar, soluble y
pequeña, esto forma una disolución.
- Insolubles y muy grandes, esto
ocurre por ejemplo con los orgánulos hialoplasmas. Estas sustancias se
sedimentan, esto se llama suspensión (disolvente/soluto).
- Entre las dos propiedades
anteriores se encuentra las dispersiones acuosas o coloidales o coloidales:
combinación del agua con otras sustancias. Aquí las otras sustancias de fase
dispersante (disolvente) y fase dispersa (soluto).
Ø Fase dispersa: es insoluble
pero no se disuelve, no es apolar. Es tan grande que no se puede disolver. No
sedimentan porque la agitación térmica del agua es suficiente para impedirlo.
Además, generalmente tienen cargas eléctricas de igual signo y se repelen.
También tiene repulsión eléctrica y turbias, se dispersan homogéneamente.
Dependiendo de
cómo sean las fases, dispersas o dispersantes, se dan tres tipos de
situaciones:
- Aerosoles: aire más líquido sólido. Esto es lo que constituyen el humo o la nieve, por ejemplo.
- Agua y sólido: si predomina el sólido, esto se llama genes, como el flan, la gelatina, el queso, etc. Si predomina el agua se llama sol, como el hielo, esto es el hialoplasma. También se llama citosol.
- Emulsiones: es la dispersión de dos líquidos inmiscibles gracias a una sustancia emulsionante. La emulsión esta estabilizada porque el jabón favorece la emulsión. La bilis estabiliza la emulsión de las grasas.
La leche,
contiene agua y grasa. La caseina de la leche emulsiona la grasa de la leche.
Todas las
propiedades nombradas anteriormente, son propiedades del agua pura. Cuando hay
una disolución las propiedades del agua varían. Todas estas situaciones que se
dan en el agua, son vitales para los seres vivos, es decir, mantener la constancia
de las variables del medio interno, la homeostasis, a mayor control del medio
interno, más independencia del medio externo y más evolución.
- Ósmosis y presión osmótica
Se define
ósmosis como una difusión pasiva, caracterizada por el paso del agua,
disolvente, a través de la membrana semipermeable, desde la solución más
diluida a la más concentrada. Hasta que se igualan las concentraciones,
difusión.
Lo que empuja
las moléculas a moverse en disoluciones es la presión osmótica, que es igual a
la concentración de un soluto.
Un caso especial
de difusión como forma de visualizar la presión osmótica, es la membrana
semipermeable (membrana plasmática, celofán, pergamino, etc.) Solo
permite el paso del disolvente pero no del soluto. El agua pasa al compartir
más concentrado, ósmosis.
Cuando la
presión hidrostática es igual que la presión osmótica, ya no pasa más agua.
El choque
osmótico es aquel al que siempre están expuestos los seres vivos en su
funcionamiento y las células no pueden soportar el choque osmótico. Esto se
llama homeostasis.
Esquema del modo de acción de la presión osmótica. En azul
se representan las moléculas de disolvente y en rojo las de soluto. La
disolución más concentrada se denomina hipertónica y la diluida
hipotónica. Como
consecuencia de la diferencia inicial de concentraciones se
produce una presión osmótica, apareciendo
diferencia de altura h, hasta que las concentraciones se
igualan.
Ejemplo de ósmosis con un
huevo: http://www.youtube.com/watch?v=1DZ569fuXxk
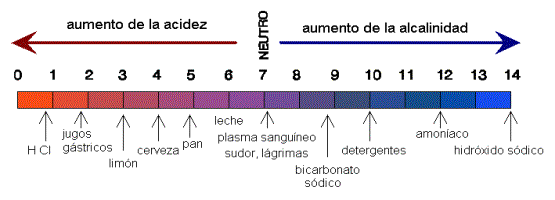
3)
Producto iónico del agua y escala de PH
El agua tiene un
electrolito débil. Es una molécula que se ioniza, es decir, gana o pierde
electrones. Solamente se ioniza 1 de cada 550 millones.
La fuerza del
puente de hidrógeno es suficiente para que una molécula capture a un protón de
la otra molécula y la primera molécula pierda un protón. Estas dos moléculas se
convierten en H3O+ y OH- . (Se
utiliza el símbolo H+, en lugar de H3O+).
Cuando la
reacción 2H2O--->(OH-) + (OH+) esta
en equilibrio, el agua pura a 25º C, resulta:
Producto de las cargas negativas por las
cargas positivas. Son inversamente proporcionales, si una carga sube la otra
carga tiene que bajar.
El agua en estas condiciones es neutra: (H+)=
(H-)= 10 exp. -7.
Se utiliza como referencia para saber si
una disolución es ácido o básica, para medir la acidez o basicidad de las
disoluciones. Si tiene más cargas positivas es ácido y si tiene más cargas
negativas es básica.
Es incómodo utilizar potencias
negativas,para facilitar esto se utiliza el concepto de:
pH = –log[10–7]
= 7, por ejemplo.
Si el PH sube disminuyen las cargas
positivas y aumentan las cargas negativas.
HA(ácido
sin disociar) → H- + A- (ácido disociado) : ácido
OHB→
O- + HO-: base
Bases del nitrógeno (NH2): Todas las
bases desprenden cargas negativas menos la base del nitrógeno, que captura las
cargas positivas: NH2 + H--> NH3
Muchas bases orgánicas son del nitrógeno.
El número de cargas que sueltan depende de
que sea un ácido fuerte (suelta mucha carga) o un ácido débil.
Cuantificado por su constante de
disociación:
En cuanto se pone en disolución fuerte se
disocia completamente |HA|=|A-|*|H+| Esto tiene una repercusión:
-Cuando un ácido esta disociado tiene
carga eléctrica. Siempre no puede afirmar que tiene carga eléctrica.
Los ácidos débiles: son los que tienen los
seres vivos. Aquí la constante de disociación no sirve, existe otro
concepto: PK.
El PK es aquel valor de PH en la que el
ácido o base débil está mitad disociada y mitad sin disociar.
Pueden o no pueden tener carga eléctrica.
Lo que nos interesa saber es si la tienen.
El PH al que se comporta como si fueran
fuerte, tiene carga eléctrica. Esto nos lleva de nuevo a la homeostasis.
Durante el metabolismo, continuamente se
producen cargas positivas y negativas.
Si se producen cargas positivas baja el
PH.
Si se producen cargas negativas sube el
PH.
Si cambia el PH se pierden cargas
deseables o se ganan cargas indeseables. Las proteínas tienen muchos ácidos de
bases débiles. Sus cargas eléctricas determinan la forma de la proteína y esta
su función.
No soportamos cambios de PH de unas
décimas sobre la neutralidad. Para contrarrestar los cambios de PH se hace
mediante un tampón, que son dos sustancias que siempre son ácido base débil que
están en cierta proporción,el tampón, capturan los H+ | HO- al capturar las
cargas no cambian el PH.
http://www.youtube.com/watch?v=U6OwBwcL9A8








No hay comentarios:
Publicar un comentario